|
Химия
Сегодня на уроке химии
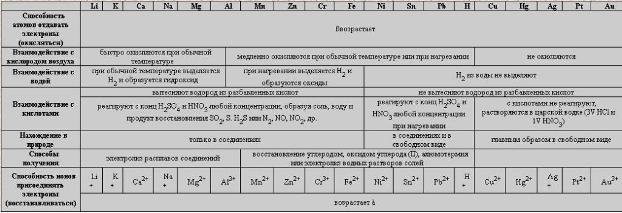
Химические свойства металлов
Электролиз
- это совокупность ОВР, которые протекают при пропускании через химическую систему постоянного электрического тока.
Электролизу подвергаются только электролиты. Образующим им ионам предварительно должна быть обеспечена свободная подвижность. Это достигается двумя способами: электролит растворяют в воде или расплавляют.
Электролиз проводят в специальных приборах – электролизерах. В него опускают электроды; один из них присоединяют к “-” полюсу – катод, другой – к “+” полюсу – анод.
На катоде – восстановление катионов.
На аноде – окисление анионов.
Электроды
Инертные (нерастворимые)
|
Активные (растворимые)
|
|
Изготовлены из угля, графита, Pt. В процессе электролиза не меняются, служат только проводниками электронов. |
Изготовлены из металлов средней активности (Cu, Zn, Co, Ni, Fe, и др.) Являясь анодами подвергаются окислению. |
Электролиз расплавов.
Катодные процессы – восстановление катиона
Анодные процессы – окисление аниона.
(если соединение содержит кислородсодержащий кислотный остаток или OH-, то окисление на аноде идёт до соответствующего оксида и O2)
Электролиз растворов.
Катодные процессы зависят от активности Me: (его положения в ряду в ряду напряжений)
от Li до Al восстанавливается вода: 2H2O + 2e- ® 2OH- + H2
от Al до H2 восстанавливается вода и металл: 2H2O + 2e- ® 2OH- + H2
Men+ + ne- ® Me0
от Cu до Au восстанавливается металл: Me n+ + ne- ® Me0
(если в растворе имеется смесь Me, то первоначально восстанавливается менее активный)
Анодные процессы – зависят от характера анода и аниона.
1. характер анода:
1.1 активный (окисляется сам анод) Me – ne- ® Men+
1.2 инертный:
2. характер аниона
2.1 бескислородный Ann- - ne- ® An0
2.2 кислородсодержащий 2H2O – 4e- ® 4H+ + O2 (в нейтральной и кислой среде)
4OH--4e-à O2+2H2O (в щелочной среде)
Органические соединения в военном деле(скачать)
Презентация: "Карбоновые кислоты"

(скачать презентацию)
Презентация: "Загрязнение окружающей среды"

(скачать презентацию)
Презентация: "Химия запаха"
Схема "Фенолы"(скачать)
Это интересно иным химикам
Вредные задачки
1.Григорий Иванович положил в карман 3 моль никеля. На сколько граммов увеличился вес Григория Ивановича?
2.У Славы дома 4 кактуса. Каждый из них за ночь поглощает 8 литров (н.у.) кислорода. Сколько граммов кислорода еженощно забирают кактусы из воздуха в квартире Славы?
3.Петя решил сжечь 0,4 моль серы. Сколько литров ядовитого сернистого газа SO2 попадет в атмосферу в результате этого эксперимента Пети?
4.Слава поливал кактус водой из-под крана. Сколько хлора досталось кактусу, если на него было вылито 400 граммов воды, в которой содержалось 0,3 грамма этого вещества?
5.Один воздушный шарик вмещает 1 литр (н.у.) кислорода. Может ли воздушный шарик содержать 0,5 моль этого газа?
6.У Васи в кармане железный гвоздь, который весит 10 г. Сколько молей железа в кармане у Васи?
7.Один из любимых кактусов Славы за сутки в результате процесса фотосинтеза вырабатывает 3,2 г глюкозы. Сколько литров углекислого газа поглощает при этом кактус, нейтрализуя последствия Славиной жизнедеятельности, и сколько граммов крахмала образуется из глюкозы?
8.Неизвестные террористы для одной пакостной проделки получили 100 г серной кислоты. Сколько молей оксида серы (VI) они растворили для этого в воде?
9.Отважные милиционеры, отобрав у неизвестных террористов серную кислоту, решили получить с ее помощью полезное удобрение для грядки с кабачками. Сколько молекул необходимого кабачкам сульфата аммония (NH4)2SO4 получат отважные милиционеры, используя конфискованную серную кислоту и аммиачную воду NH3∙H2O?
10.Совершенно случайно Васе в руки попали кусочек сплава меди с железом массой 4,7 г и концентрированная азотная кислота. Повинуясь внутреннему голосу, Вася кинул сплав в кислоту. Из пробирки повалил бурый газ, объем которого наметанный Васин глаз зафиксировал: 1,8 л (н.у.). Чему была равна масса железа в сплаве до опыта?
11.Вася подмешивал сахар в суп Клавдии Петровне. Сколько граммов сахара получит сегодня на обед Клавдия Петровна, если в 250 мл супа (плотность 1,1 г/мл) содержится теперь 30 % этого калорийного вещества?
12.В среднем взрослому человеку требуется в сутки 10 000 кДж энергии. Если бы наш организм использовал в качестве «двигателя» всех процессов энергию реакции 2Н2+O2=2H2O+484 кДж, сколько литров водорода (н.у.) расходовал бы каждый из нас в сутки?
13.Вася нашел на улице емкость объемом 15 л, заполненную газом неизвестного происхождения. Вызванные на помощь эксперты сумели определить массу подозрительного газа (она составила 30,3 г) и давление газа на стенки сосуда (122 кПа). Измерив на всякий случай температуру воздуха на месте происшествия (18 C), эксперты вместе с емкостью отбыли в известном направлении. Чему равна молярная масса газа, который нашел бдительный Вася? Какое это может быть вещество, если было выяснено, что оно относится к непредельным углеводородам?
Готовимся к экзаменам по химии
Экзаменационные билеты 9 класс 2007г.
Билет №1
Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома, их значение для химической науки.
Билет №2
Виды химической связи: ковалентная (полярная и неполярная), ионная, металлическая.
Билет №3
Классификация химических реакций по различным признакам: по числу и составу реагирующих о образующихся веществ; изменению степени окисления атомов химических элементов, образующие эти вещества; агрегатному состоянию этих веществ; тепловому эффекту; направлению химических процессов; использованию катализатора.
Билет №4
Скорость химической реакции и факторы, влияющие на нее: природа реагирующих веществ, концентрация их, температура протекания химической реакции, поверхность соприкосновения реагирующих веществ, катализатор.
Билет №5
Обратимость химических реакций. Условия их необратимого протекания. Химическое равновесие и способы его смещения.
Билет №6
Основные положения теории электролитической диссоциации. Классификация электролитов по силе и типу образующихся при диссоциации ионов. Классификация ионов: по составу, по заряду, по наличию водной оболочки.
Билет №7
Оксиды: их состав, классификация и названия. Химические свойства основных, амфотерных и кислотных оксидов.
Билет №8
Кислоты в свете теории электролитической диссоциации: их классификация и химические свойства.
Билет №9
Основания в свете теории электролитической диссоциации: их классификация и химические свойства.
Билет №10
Соли в свете теории электролитической диссоциации: их классификация и химические свойства.
Билет №11
Генетическая связь между классами неорганических соединений. Генетические ряды: металла, неметалла, переходного элемента.
Билет №12
Металлы, их положение в Периодической системе химических элементов Д. И. Менделеева, строение атомов и кристаллов. Общие физические свойства металлов.
Билет №13
Общие химические свойства металлов. Электрохимический ряд напряжений металлов и взаимодействие металлов с растворами кислот и солей.
Билет №14
Металлы в природе. Общие способы получения металлов. Металлотермия.
Билет №15
Коррозия металлов, ее классификация и способы защиты от коррозии.
Билет №16
Общая характеристика щелочных металлов: строение атомов и свойства простых веществ в сравнении. Важнейшие соединения: оксиды, гидроксиды, соли, - их представители и их значение в природе и жизни человека.
Билет №17
Общая характеристика галогенов: строение атомов и свойства простых веществ в сравнении. Важнейшие соединения: галогеноводороды, соли, - их представители и их значение в природе и жизни человека.
Билет №18
Воздух. Его состав, использование как сырья для химической промышленности. Основные загрязнители атмосферы и способы их устранения.
Билет №19
Вода. Ее состав, строение молекулы, физические и химические свойства (Взаимодействие со щелочными и щелочноземельными металлами и оксидами). Биологическая роль воды. Защита гидросферы от химического загрязнения.
Билет №20
Жесткость воды ее классификация и способы устранения.
Билет №21
Характеристика одного из элементов-металлов ( натрия, кальция, алюминия, железа): строение атомов и кристаллов; свойства простого вещества, оксидов, гидроксидов. Важнейшие соли.
Билет №22
Характеристика одного из элементов-неметаллов ( хлора, серы, фосфора, азота, углерода, кремния, кислорода, водорода): строение атомов и кристаллов; аллотропия, свойства простого вещества, водородного соединения, оксидов, кислородных кислот. Важнейшие соли.
Билет №23
Особенности строения органических соединений. Формулы: молекулярные, структурные, электронные. Понятие изомерии.
Билет №24
Характеристика углеводорода (любого на выбор).
Билет №25
Характеристика кислородсодержащего органического соединения (любого на выбор).
Билет №26
Счастливый билет.
Билет №27
Счастливый билет.
|